生物正交催化能实现复杂生活环境中的大量的非自然化学转化,如生物分子标记和前药激活的交叉耦联和保护基团裂解反应。这类化学物质的实现主要依赖于非生物过渡金属(TMs),包括Pd、Au、Ru、Ir和Cu,它们通常以金属配合物和金属纳米颗粒的形式存在。但由于其不可预测的毒性、缺乏目标性和稳定性有限等弊端,金属复合物的应用主要局限于细菌和细胞研究。为了改善TMs的潜在毒性,近些年的研究集中于TM纳米颗粒的载体树脂磁珠上,以实现细胞内外的异质生物正交催化,但这类移植通常需要复杂精密的手术。注射TMs虽然也同样可以提高体内生物正交催化的反应效率,但仍然存在关于在治疗后如何重复提取TMs、潜在的金属毒性、免疫原性和由非特异性沉积引起意外催化等缺点。基于以上考虑,一些可以以微创和空间控制的方式工作的生物正交催化装置将为高效生物正交催化反应提供巨大的多样性。
因此,浙江大学顾臻教授团队开发了一种简单而强大的生物正交催化微阵列贴片,用于在体外和体内催化生物正交化学,从而直接在肿瘤内部产生抗癌治疗剂。该贴片是以聚乙烯醇(PVA)基质制成的催化活性微纳米片装置,由二氧化钛纳米片(Pd-TNSs)作为纳米填充剂。Pd-TNSs的加入是为了增强了微针在干燥玻璃状态下的机械性能,赋予它们足够的强度,以微创的方式穿透皮肤。一旦置于水环境中,微针就会变成膨胀的水凝胶状态,形成多孔结构。因此,该三层次的结构层次(3D针阵列、每个针基质中的微孔和网络中高度暴露的Pd-TNSs表面)促进了前药分子的扩散以与Pd纳米颗粒接触,进而促进了前药的活化。(图1)
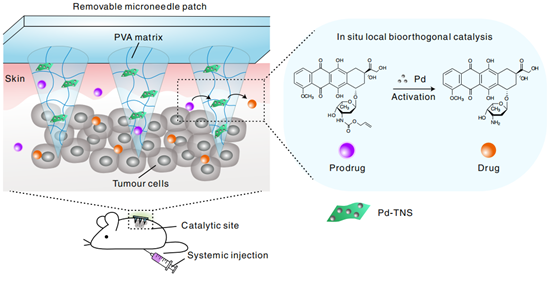
图1. 微阵列贴片的三组分结构层次设计,以及其在进入肿瘤组织区域后介导的过渡金属催化的生物正交反应前药释放的示意图
随后,团队通过多种方法对该微阵列贴片的形貌、功能等进行了表征。首先,研究了负载钯金纳米颗粒的二氧化钛纳米片(Pd-TNSs),通过对其形貌、元素组成分布等对材料的形成进行了分析(图2b-e),也通过让该纳米片与一种荧光染料RH110的猝灭前体反应复原,证明了钯金纳米颗粒的反应活性。(图2f-g)。在将其与纳米填充剂PVA复合后,制备成了微针贴片(PT-MNs),同样地,利用扫描电镜对微针贴片的形貌进行了分析,荧光复原实验也证明了在微针贴片中钯的催化生物正交反应活性随着与PVA复合时间的延长而逐渐恢复。(图3)
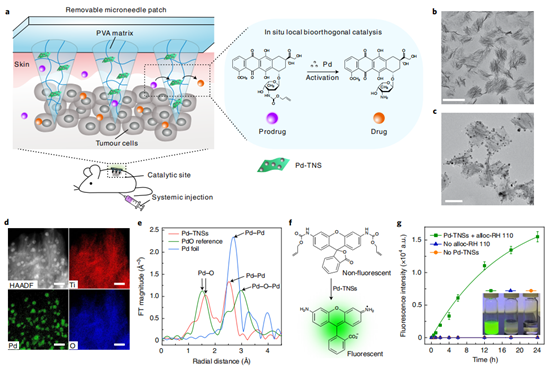
图2. 对二氧化钛纳米片(Pd-TNSs)的表征,用透射电镜和元素映射分析对其形貌、元素组成的表征,通过荧光染料RH110猝灭前体的复原动力学证明钯的活性
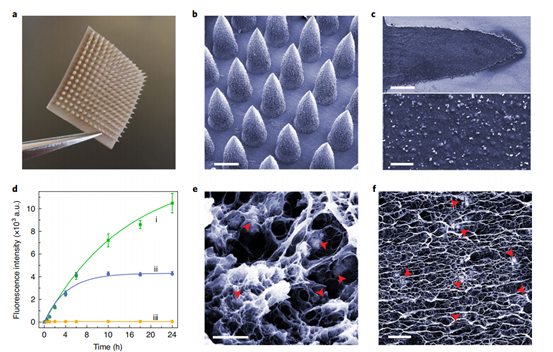
图3. 对微针贴片(PT-MNs)的扫描电镜表征以及荧光复原动力学表征
在这之后,该团队验证了在体外细胞群中,PT-MNs可以生物正交催化细胞外培养基中RH 110荧光猝灭前体alloc-RH110的释放,然后释放的荧光团扩散到整个细胞群中。共聚焦显微镜和流式细胞术已经很明显地验证了这一点(图4),随着培养时间的延长,荧光有着显著的增强。同样地,在体外,Pd-TNSs还催化溶液中alloc-DOX的降解,进而激活 DOX的疗效。细胞毒性实验、流式细胞术、FITC-dUTP染色实验都显著地表明了DOX杀伤细胞作用的恢复。(图5)
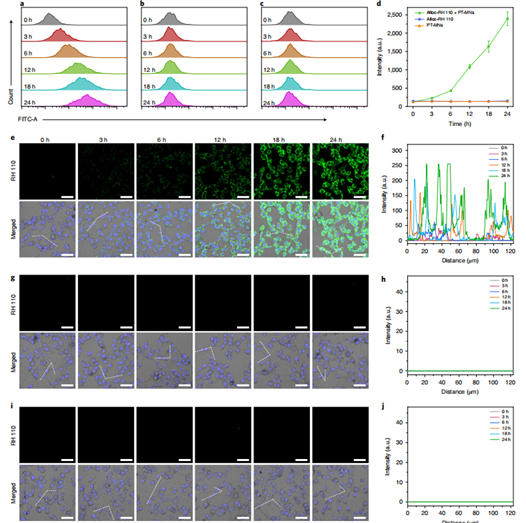
图4. PT-MNs介导的生物正交催化反应用于体外荧光标记。以alloc-RH110+PT-NMs为实验组、游离的alloc-RH110和游离的PT-NMs为对照组进行实验,a-d为流式细胞术验证结果,e-i为共聚焦显微镜拍摄结果
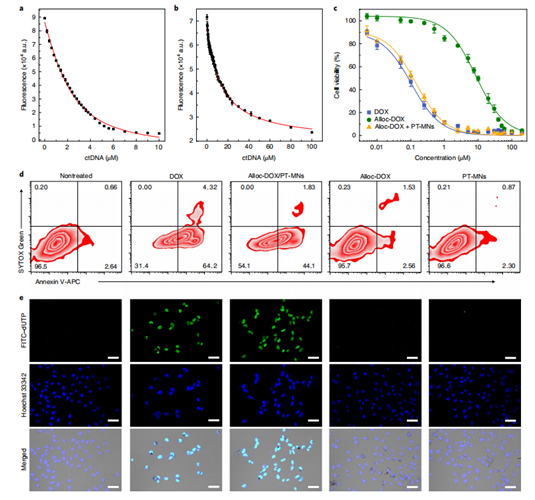
图5. PT-MNs介导的生物正交催化反应用于体外药物释放。以alloc-DOX+PT-NMs为实验组、游离的DOX、游离的alloc-DOX和游离的PT-NMs为对照组进行实验,a-c为细胞毒性实验结果,d和e分别为流式细胞术和FITC-dUTP验证实验结果
在动物实验中,通过将贴片轻柔地压在黑素瘤肿瘤部位上的皮肤上,微针可以完全穿透皮肤并插入其中,贴片组可以明显地抑制肿瘤的生长,而且避免了直接注射药物的高毒副作用,并且有很好的效果。组织分布、抑瘤实验以及对切片肿瘤组织中细胞死亡情况的分析都证明了PT-MNs在动物体内发挥了生物正交催化反应功能,最终导致了前药的释放。(图6)
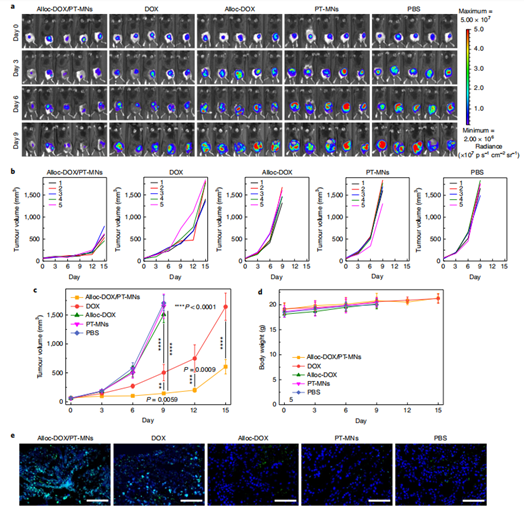
图6. PT-MNs介导的体内原药激活的抗癌活性研究 a.给药后的组织分布情况 b-d.抑瘤实验结果 e.肿瘤组织切片情况证明了实验组可以发挥药物毒性作用,同时可以以较大的用量给药,避免了对正常组织的毒性。
该材料的一个非常大的特点是易于除去。在给药之后,PT-MNs贴片可以以水合状态抽出而没有明显的损害。这是因为,Pd-TNS和PVA之间的界面相互作用以及由PVA链形成的氢键在微针上具有足够的机械韧性(在水合物状态下),从而易于去除整个贴片,而不会留下有害的粒子或引起炎症。
总而言之,该团队发明了一种基于微针的生物正交催化反应装置,并证明了其在体外体内调节生物无害物质的生物正交转化为活性剂方面有很大的应用前景。该生物正交催化反应贴片有着较高的稳定性,良好的生物相容性和易于去除等特性,并且可以在水溶液,细胞外空间和组织的选定区域中有效地将惰性底物转化为有利状态。该贴片同样能够在肿瘤部位激活抗癌药物,并以恢复其药理特性,通过这种方式,脱靶激活或对远处器官或组织的剂量依赖性副作用得以缓解。这种生物或正交过程仅在前药和微针装置结合时才能产生治疗效果,从而避免了传统的无痛药物释放系统中可能发生的药物泄漏。这种技术是用生物正交化学方法在生物体中局部地作用某一特定区域,诱导相关生物过程的进行,为靶向药物释放领域提供了新的思路。
原文链接:https://www.nature.com/articles/s41565-021-00910-7
DOI:10.1038/s41565-021-00910-7





暂无评论
发表评论