现代癌症治疗的选择已经从对手术和放射疗法的依赖转向了对系统性疗法的日益重视,如激素疗法、化疗和免疫疗法。在这些治疗方案中,化疗仍然是常见癌症晚期和转移阶段的主要系统性治疗。然而,由于耐药性、缺乏肿瘤特异性选择性和潜在的毒性,常规的化疗药物往往会遭受相当大的疗效损失。
在此背景下,应用天然细胞毒性肽(NCPs)是癌症预防和治疗的一种很有前途的替代方法。在自然界中,阳离子NCPs通过溶解癌症细胞膜表现出很强的溶瘤活性,其能选择性杀伤肿瘤细胞,继而释放肿瘤相关抗原启动机体系统性抗肿瘤免疫。如蜘蛛蜂毒囊中最短的(10个氨基酸)、线性α螺旋的NCP,因其结构简单、活性范围广泛,缺乏溶血毒性等而引起了广泛关注。
然而,由于其构象不稳定性、易受蛋白水解降解的影响等问题,阻碍了其进一步的开发和应用。因此,上海中医药大学交叉科学研究院张卫东及陈红专教授团队基于构象锁定订书肽策略,成功设计合成了系列蜂毒肽anoplin构象锁定衍生物(Stapled anoplin peptides, StAnos),通过比较这一系列StAnos衍生物的稳定性和构效关系,筛选出最优化合物Ano-3s。
随后深入开展其体内、外溶瘤作用评价,并阐明溶瘤蜂毒肽诱导肿瘤细胞免疫原性细胞死亡(immunogenic cell death, ICD),激活CD8+ T细胞介导的黑色素瘤溶瘤免疫作用的新机制(图1)。

图1 蜂毒肽Anoplin构象锁定衍生物(StAno)免疫治疗设计的原理图和基于StAno免疫治疗的作用机制
由于蜂毒肽的超短结构,其总共拥有10个氨基酸,是非常有利于设计和生产构象锁定衍生物的。通过执行“锁定扫描”,以订书肽策略将锁定段沿蜂毒肽序列放置,合成了11个StAnos。先用构象、电荷和4T1抗肿瘤活性等几个要素初步筛选,最终选择了具有显著α-螺旋刚性、高效溶瘤作用和安全性较好的候选分子Ano-3。然后,针对Ano-3水溶性不足的问题,采用新型的双侧链保留多肽构象锁定技术对其进行修饰,合成了其衍生物Ano-3s。(图2,3)

图2 (A)系列StAnos的C-18 HPLC保留时间、电荷、螺旋型以及4T1抗肿瘤活性的数据筛选; (B) 系列StAnos的合成路线; (C) 锁定链结构对于蜂毒肽构象影响的表征情况、
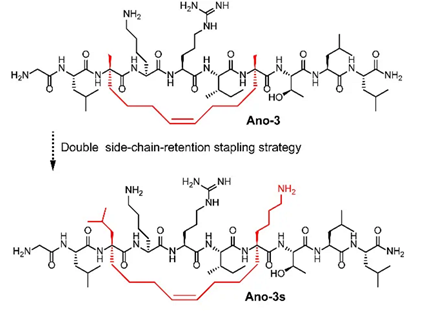
图3 化合物Ano-3及其水溶性较好的衍生物Ano-3s的结构比较
作者团队首先研究了Ano-3通过膜溶解快速杀死癌细胞的能力。为了描述结构锁定后抗菌肽的细胞膜溶解能力,定义了溶解指数LI和疏水性网络原理图HMNs。通过衡量这两个指标,发现Ano-3相比于其他溶瘤肽有着明显的优势。通过红细胞(RBC)溶血测定比较三种溶瘤肽的实际溶血活性,其结果也与指标预测一致。随后进行的细胞杀伤实验也表明,Ano-3相对于目前已经临床二期阳性溶瘤肽LTX-315也展现出了优势。(图4)
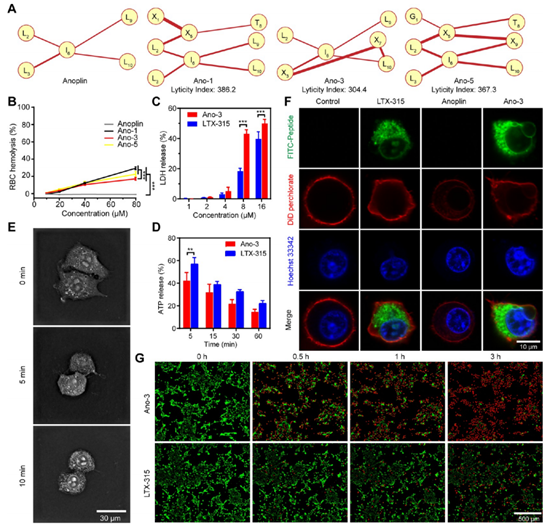
图4 三种溶瘤肽的HMNs和LI预测值以及其红细胞溶血实验测试指数,Ano-3和LTX-315的细胞杀伤能力对照
体外抗肿瘤作用及初步成药性研究表明(图5),Ano-3s亦可通过快速裂解肿瘤细胞膜的作用,高效抑制体外肿瘤细胞增殖,抑瘤效果与Ano-3相当。值得注意的是,水溶性改善后的Ano-3s其溶血副作用进一步降低,且Ano-3和Ano-3s的耐蛋白酶水解能力均显著优于原型化合物Anoplin及阳性对照LTX-315。以上结果显示,Ano-3s有望成为后续研究的先导化合物。

图5 化合物Ano-3s的各项基本性质、体外合成的高选择性以及其与对照组相比的快速溶瘤作用
体外验证了Ano-3s的溶瘤作用后,作者团队分别在三阴性乳腺癌肿瘤模型4T1和黑色素瘤模型B16F10上进行了动物实验。抑瘤实验结果显示,在B16F10肿瘤模型中,Ano-3s体现了良好的抑瘤活性,但4T1肿瘤模型却未能受到较好的抑制效果(图6)。通过思考B16F10肿瘤和4T1肿瘤微环境的不同,发现其CD8+ T细胞浸润的程度有明显的区别。因此判断Ano-3和Ano-3s可通过高效溶瘤作用诱导肿瘤ICD效应,提示肿瘤免疫抑制微环境(TumorImmunosuppressive microenvironment, TIM)是溶瘤肽体内疗效发挥的潜在限制性因素。
当团队采用中和抗体清除黑色素瘤荷瘤小鼠体内CD8+ T细胞后,Ano-3s抑瘤效果受到显著抑制,证明溶瘤肽抑瘤作用显著依赖CD8+ T细胞的浸润(图7)。免疫组化染色图像也表明,经过Ano-3或Ano-3s处理的B16F10肿瘤组织中,CD8+ T细胞显著浸润,表明Ano-3和Ano-3s可以通过高效溶瘤作用激活体内抗肿瘤免疫,并促进CD8+ T细胞浸润(图8)。
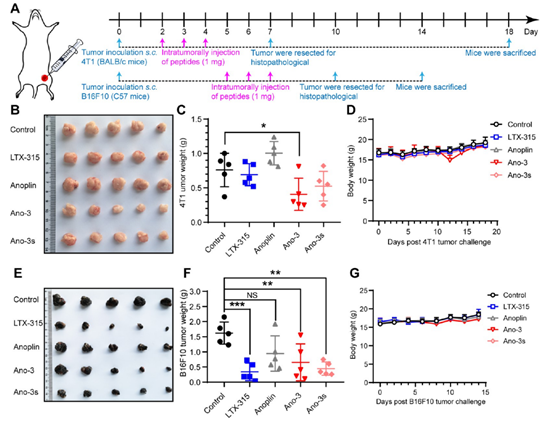
图6 溶瘤肽Ano-3和Ano-3s在B16F10和4T1肿瘤模型上的抑瘤效果对比
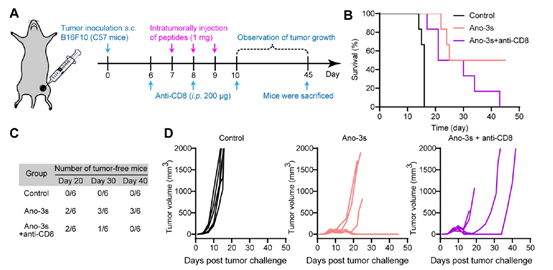
图7 采用中和抗体清除黑色素瘤荷瘤小鼠体内CD8+ T细胞后,Ano-3s抑瘤效果受到显著抑制

图8 免疫组化染色图像表明Ano-3和Ano-3s可以通过高效溶瘤作用激活体内抗肿瘤免疫,并促进CD8+ T细胞浸润
由于目前溶解肽的内在缺陷,包括体内循环半衰期短、生物利用度差和全身毒性不良,瘤内注射是临床给药的合理选择。在这种情况下,该团队使用订书肽策略的开创性努力可能作为潜在的驱动力,以加速溶瘤肽的发展、以及其作为新的系统化疗与治疗应用的改进。本研究为构象锁定技术在天然来源多肽药物开发中的应用提供重要前期数据和创新思路,并为溶瘤肽免疫协同治疗在黑色素肿瘤中的创新应用提供重要依据。
原文链接:https://pubs.acs.org/doi/10.1021/acs.jmedchem.0c02237
DOI:10.1021/acs.jmedchem.0c02237





暂无评论
发表评论