文章亮点
1. 本文中报道了一种诱导内质网应激的环金属化Ir(III)-bisNHC复合物作为新的ICD诱导剂,并基于该化合物设计了一种可点击的光亲探针用于目标识别,揭示了未折叠蛋白反应途径的主调节蛋白BiP(结合免疫球蛋白)/GRP78的参与。
2. 作者研究了一系列环金属化铱(III)配合物,并成功揭示了含有双-N-杂环卡宾 (bisNHC) 配体。该复合物能够诱导ICD的所有特征,并在小鼠模型中显示出与奥沙利铂相似的疫苗接种效果。
3. 文中设计了一种含有二苯甲酮和炔烃的同源探针。目标分析和验证实验强调了结合免疫球蛋白(BiP)的参与,BiP是一种控制 ER(内质网)止血的关键蛋白,与肿瘤的ICD抵抗能力密切相关。这是首次通过化学生物学方法获得ICD的直接靶标信息。
背景介绍
免疫原性细胞死亡 (ICD) 是一种独特的细胞死亡反应模式,可通过诱导损伤相关分子模式 (DAMP) 信号,如钙网蛋白 (CRT) 的表面暴露、ATP的释放和HMGB的分泌。对于癌细胞,ICD过程中释放的免疫刺激信号导致树突状细胞 (DC) 增强了对癌细胞的吞噬,树突状细胞是免疫系统中最有效的抗原呈递细胞。抗原将由DC呈递给相关的T细胞,从而激活全局抗癌免疫反应。经过数十年的努力,发现ICD可被多种死亡类型诱导,包括坏死性凋亡、焦亡、和某些类型的细胞凋亡。相应地,已经确定了各种ICD诱导因素,例如微生物成分、辐射,特别是化学疗法。
具有抗肿瘤免疫的化疗药物可以带来巨大的好处:它们对快速生长的癌细胞产生细胞毒性的“第一击”,以及宿主免疫系统引发肿瘤特异性免疫反应的“第二击”。值得注意的是,研究表明临床相关ICD诱导剂(例如,奥沙利铂和阿霉素)与 PD-1/PD-L1 抑制剂的联合使用已被证明具有良好的协同效应。最近的一项调查还指出,ICD药物环磷酰胺和奥沙利铂, CAR-T细胞通过改变肿瘤微环境来实现免疫抑制实体瘤。因此可以预见,基于ICD的化学疗法将在未来的免疫治疗中发挥更重要的作用。
在这项工作中,作者旨在基于新发现的ICD诱导剂了解ICD的分子机制。鉴于不断诱导的ER应激是ICD的一个关键特征,我们研究了一系列环金属化铱 (III) 配合物,并成功揭示了含有双-N-杂环卡宾 (bisNHC) 配体。设计了一种含有二苯甲酮和炔烃的同源探针。以下目标分析和验证实验强调了结合免疫球蛋白 (BiP) 的参与,BiP是一种控制ER止血的关键蛋白,与肿瘤的ICD抵抗能力密切相关。使用临床相关ICD药物的进一步研究表明,BiP目标的普遍参与。这是首次通过化学生物学方法获得ICD的直接靶标信息,我们相信这将有助于了解ICD背后的分子基础,并有利于新诱导剂的设计更好的性能。
图文速读
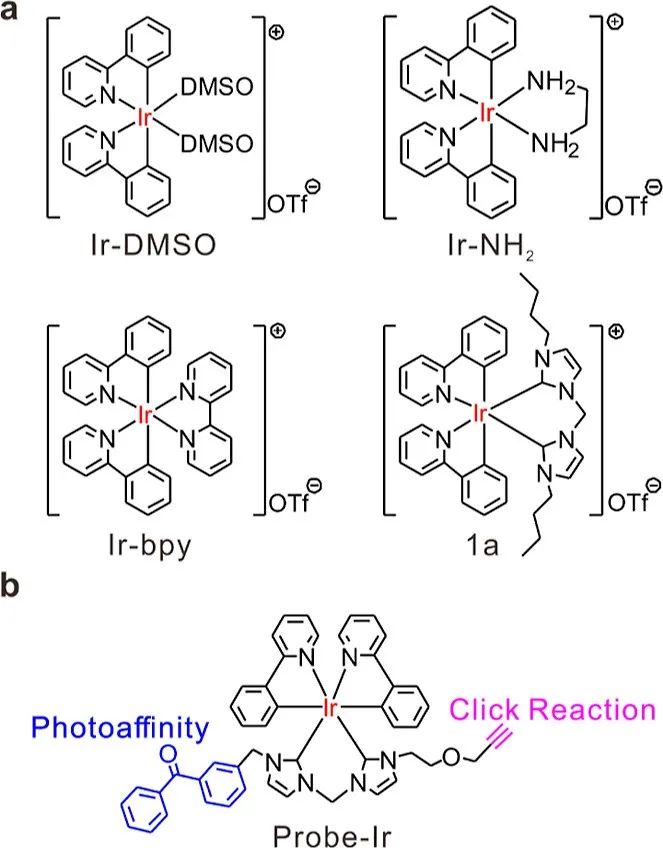
图1 本研究中使用的 Ir(III) 配合物的化学结构。
(a)用于 ectoCRT 筛查的 Ir(III) 配合物示例。
(b)用于目标分析的 1a 的光亲探针。
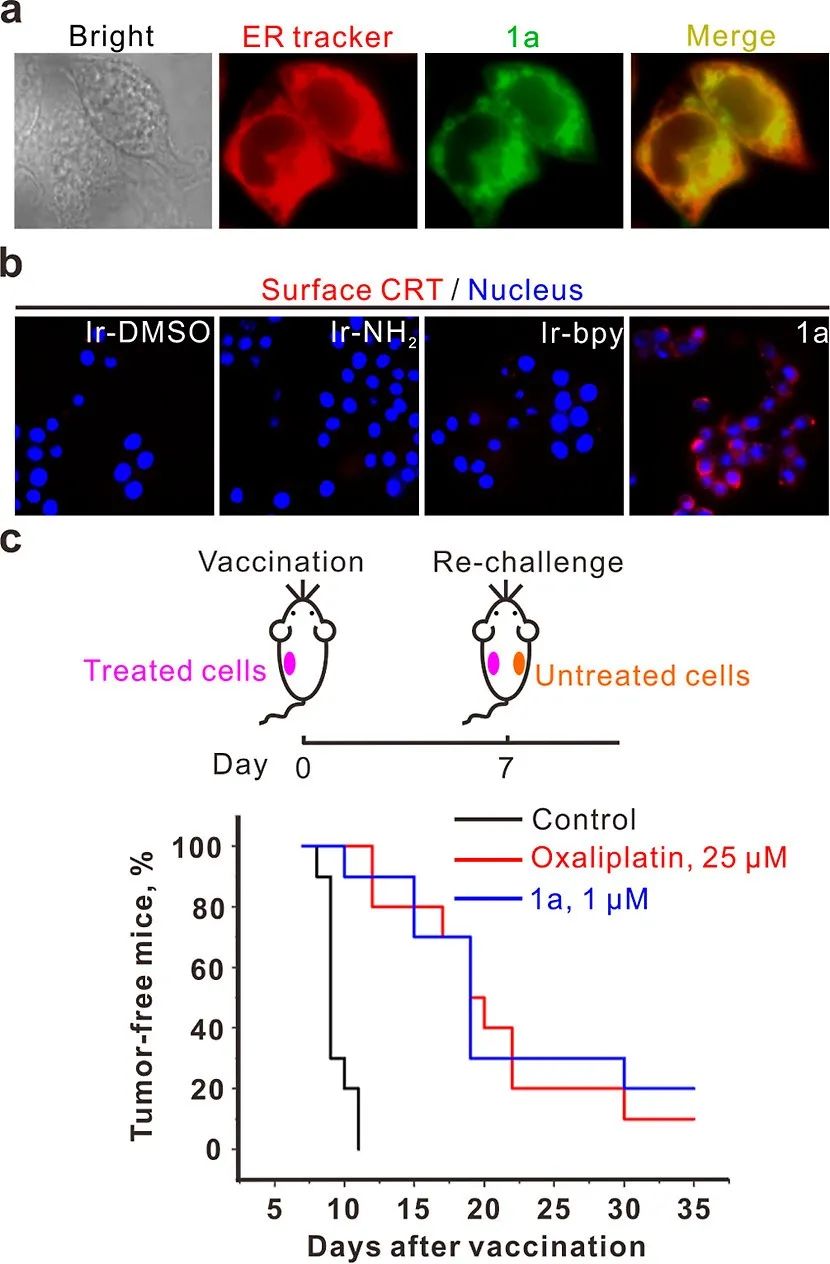
图2 1a对ICD的诱导。
(a) 1a的亚细胞定位。HCT116细胞在1a处理(12 μM,15分钟)后用ER Tracker染色。1a的绿色荧光与ER Tracker的红色信号合并。
(b) 在指示的Ir(III)配合物 (12 μM, 3 h) 处理下进行ectoCRT检测。
(c) 使用小鼠CT26结肠癌细胞对1a进行小鼠疫苗接种实验。将处理过的CT26细胞注射到小鼠的左侧。7天后,将未处理的细胞注射到右侧。重新注射后的无肿瘤小鼠百分比显示在指定的治疗中。
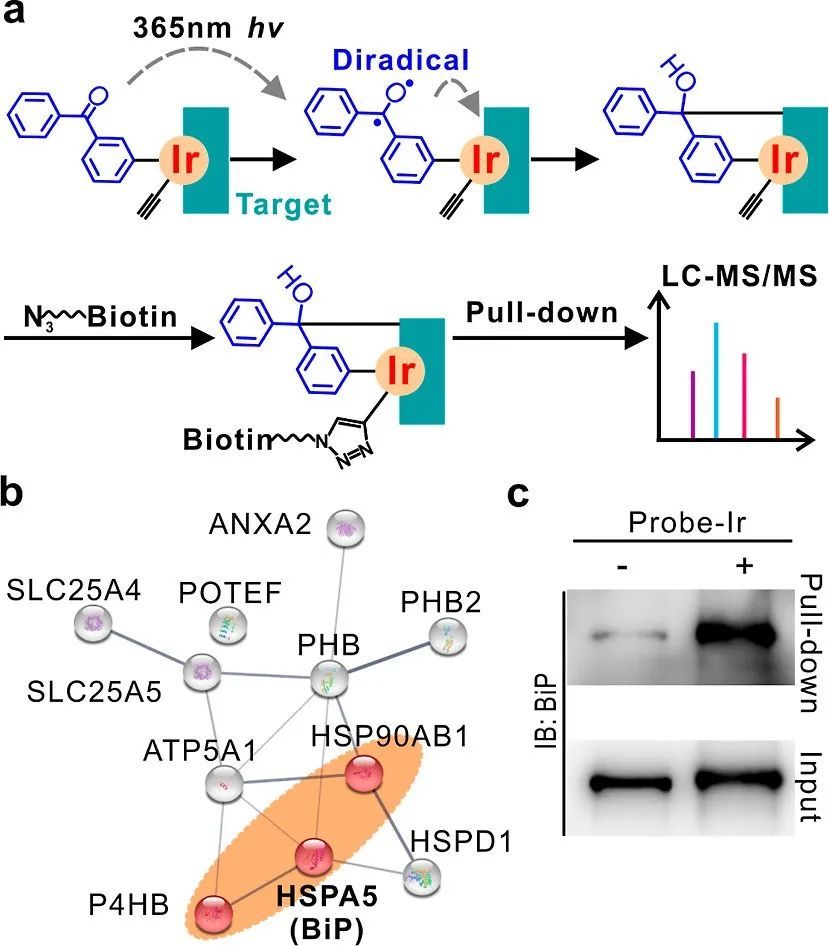
图3 使用1a衍生的光亲探针Probe-Ir进行目标分析。
(a) 目标蛋白捕获和识别的工作流程图。
(b) 蛋白质关联网络由网络服务器 STRING 分析。线条代表经过实验验证的相互作用,粗细反映了数据支持的强度。通过KEGG通路分析属于ER中的蛋白质加工的三个蛋白质点被标记为红色并突出显示。
(c) BiP的下拉蛋白质印迹验证作为Probe-Ir的ER目标。“输入”图像表示裂解物中的BiP量。
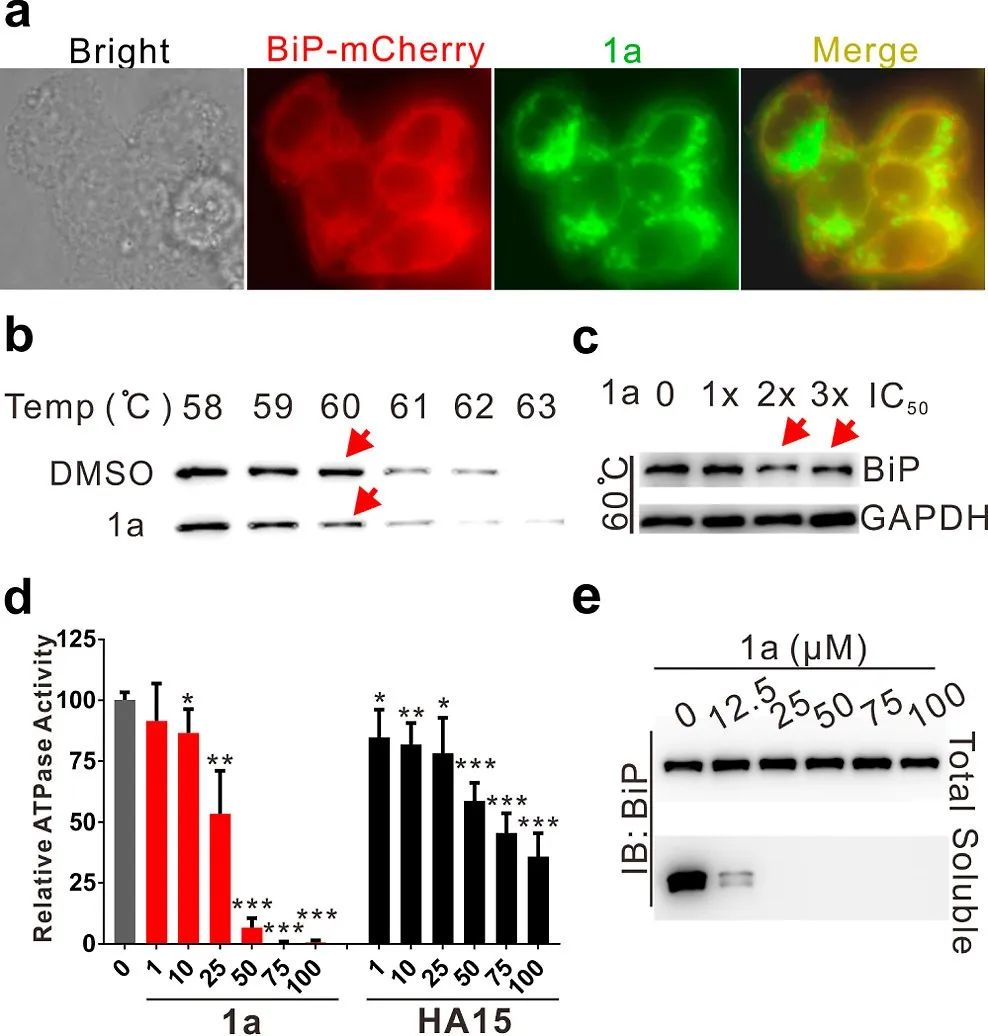
图4 使用1a验证BiP参与。
(a) BiP和1a的共定位。用 BiP-mCherry 质粒转染 HCT116 细胞以表达荧光标记的BiP。
(b) 在指定温度下BiP的CETSA的蛋白质印迹图像。
(c) 在1a处理并在60°C BiP下HCT116细胞中的ITDR测定。检测的GAPDH蛋白作为加载对照。
(d) 1a或HA15指示浓度下BiP的的ATP酶活性。数据代表平均值±标准差(未配对的双侧学生t检验;n =来自三个独立实验的3个总数据点)。*p < 0.05,**p < 0.01,***p < 0.001。
(e) 1a诱导的BiP溶解度降低。可溶性部分代表离心后上清液中的可溶性BiP。每次实验使用0.25 μM BiP,指定浓度为1a。总样品是在没有离心的情况下获得的。
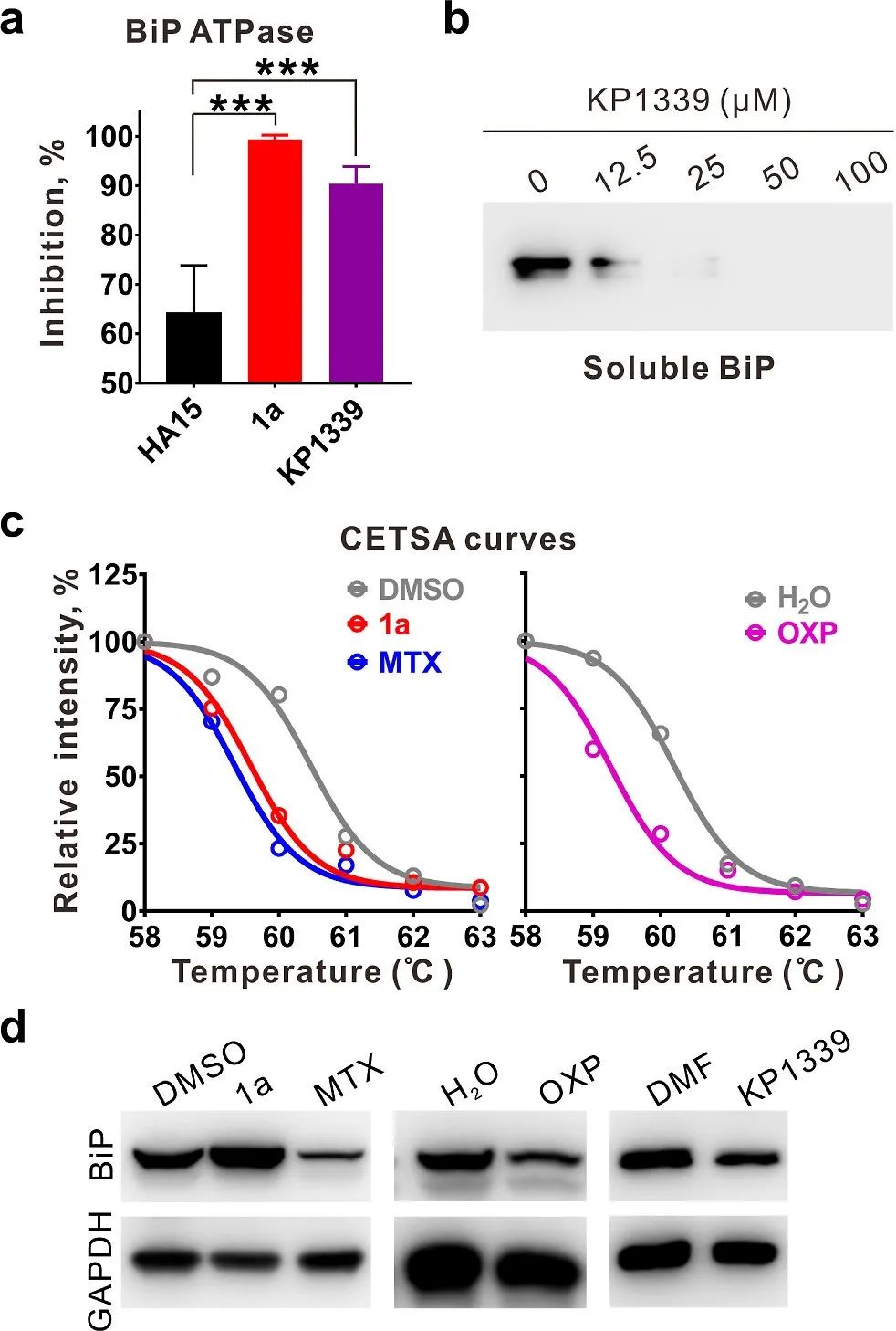
图 5 BiP与其他ICD诱导剂的关联。
(a) KP1339对BiP ATPase活性具有抑制作用。通过归一化到每种化合物的同源溶剂对照来计算抑制比。数据代表平均值±标准差(非配对双向学生t检验;来自至少三个独立实验的数据点)。对HA15组的显着性用星号标记,***p < 0.001。
(b) 在KP1339处理后,BiP的溶解度降低。
(c) 比较ICD药物MTX、OXP和1a的CETSA曲线。将指定温度下的蛋白质印迹的条带强度归一化为 58°C 时的条带强度。每个数据点是三个独立测定的平均值。
(d) 在指定处理下HCT116细胞中的BiP水平。该图像代表重复实验。
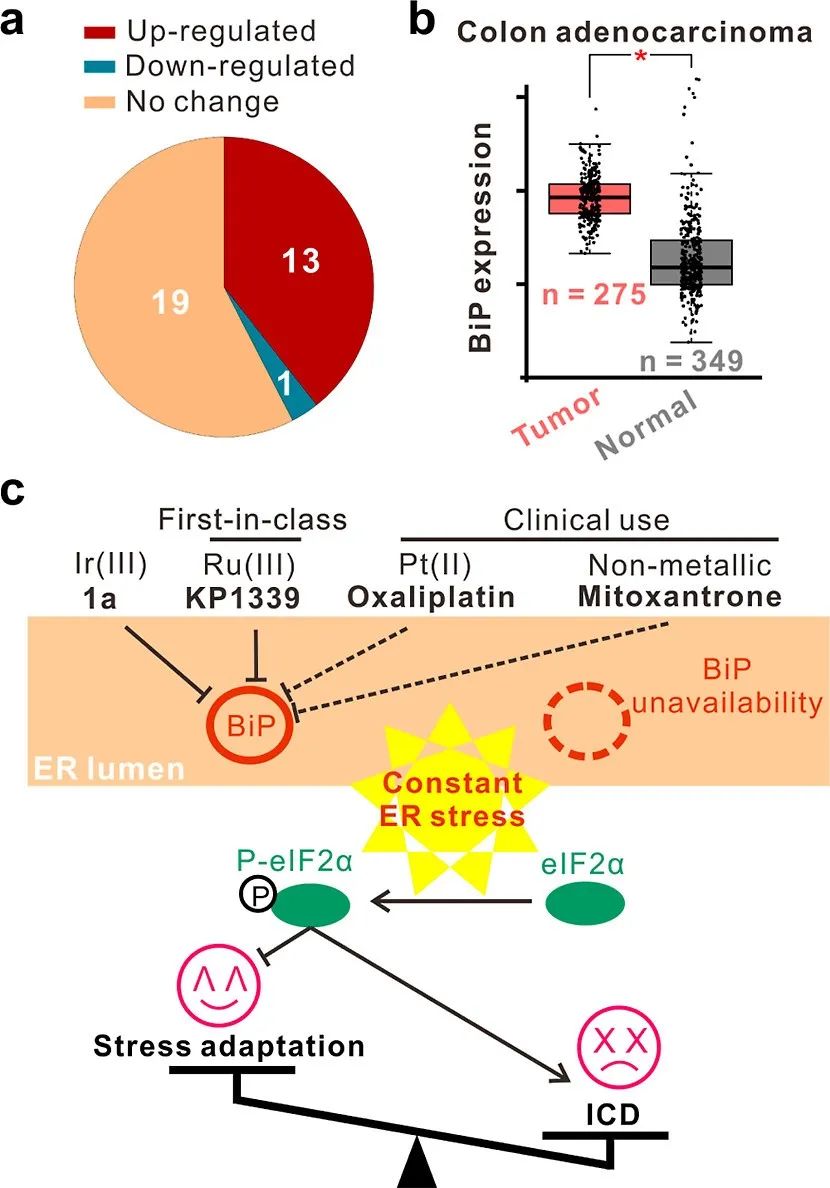
图6. BiP在癌症和ICD中的作用。
(a) 不同肿瘤和同源正常组织中BiP mRNA表达的扇形图。基于TCGA数据库,总共考虑了33种癌症类型。肿瘤与正常组织中BiP的升高和降低的组分别标记为红色和青色。没有显著变化的癌症以浅橙色表示。
(b) BiP在结肠腺癌中的mRNA 表达。肿瘤组织的数据来自TCGA,而正常组织的数据来自TCGA和GTEx数据库。该图表由GEPIA2 Web服务器生成。
(c) 这项工作中的发现示意图。
结论与展望
作者鉴定出一种含有双NHC配体的环金属化Ir(III) 配合物,在体外和体内具有有效的ICD活性。基于这种ICD诱导剂的可点击光亲探针揭示了在细胞条件下BiP靶向的强大参与。进一步的生化研究表明,该复合物有效地使BiP不稳定,导致抑制ATP酶活性的能力比文献报道的抑制剂HA15高得多。其他与临床相关的 ICD 诱导剂的研究表明,BiP直接参与蛋白质结合或抑制。
强烈破坏ER稳态的化合物可能会引发有效的DAMP释放。使用此处确定的 BiP 靶向,可以设计具有抑制BiP活性的新ICD化合物。值得注意的是,BiP已被证明是一种重金属的细胞内传感器。这种特性可能有助于其对金属药物的敏感性,因此ICD化合物的未来设计可以使用1a的支架和其他已知的ICD金属试剂作为设计开始的线索。由于金属配合物与生物分子靶标的结合相互作用可以通过配体设计进行系统调整,可以设想金属配合物可以开发为具有高特异性和强大功效的有效ICD诱导剂。除了合理的设计外,使用多种针对BiP的小分子(阻断其表达或酶活性)进行高通量筛选也可能有助于发现新型 ICD 药物。









暂无评论
发表评论