一、背景介绍
2007年中科院生物物理所的阎锡蕴课题组在一次偶然的实验中,发现Fe3O4 NPs具有类似于辣根过氧化物酶(POD)的活性,能够使底物着色,从而发现了纳米酶的存在。
纳米酶被定义为具有类似酶活性的功能纳米材料,纳米酶由特殊纳米结构的纳米材料组成,特殊的纳米结构赋予了纳米酶独特的化学性质,能够在生理环境下催化底物与天然酶的反应;纳米酶独特的纳米尺度因素,如尺寸、形态以及纳米酶的表面等影响其活性的因素,为调节纳米酶活性提供了优异的策略。纳米酶可以分为过氧化物酶、过氧化氢酶、超氧化物歧化酶、氧化酶和水解酶等几种。
纳米酶可以突破天然酶稳定性低、成本高、不易储存的限制,因此逐渐应用于从生物医学传感、基因治疗到环境保护的各个领域。例如,通过在重组人重链铁蛋白纳米笼内包封氧化铁纳米粒子制备铁丝蛋白纳米酶(M-HFn)。M-HFn可以特异性识别肿瘤组织过度表达的转移受体并在H2O2存在下催化过氧化物酶底物发生颜色反应,从而可以用于肿瘤的可视化。利用石墨烯量子点纳米酶可以实现异种移植鼻咽癌的H2O2响应催化光生成像。碳纳米酶在肿瘤酸性环境中选择性的具备氧化酶和过氧化物酶活性,通过将O2和H2O2转化成为自由基进而增加体内ROS浓度,抑制肿瘤的生长。基于中国原创的纳米酶的研究一直吸引着全球研究者的兴趣。
二、文献分析
1、纳米酶增强水凝胶促进骨整合


类风湿性关节炎(RA)是最广泛和最具破坏性的自身免疫性疾病之一。它的主要特征是滑膜炎症,进一步发展并导致关节疼痛、僵硬、功能丧失,在某些情况下,活动受限最终导致关节置换手术以恢复功能和减轻疼痛。RA给患者带来了巨大的社会磨难和日益增加的经济困难。虽然多种治疗方法已经被开发出来,但对风湿性关节炎微环境的完全恢复或消除还远远不能令人满意。基于干细胞的治疗已经成为一种有前途的风湿性关节炎治疗的替代方法,它比传统的介入或药物治疗有许多重要的优势。
在这项工作中,研究者开发了纳米酶增强水凝胶作为H2O2驱动的制氧器来调节干细胞行为。这种生物代谢激发的水凝胶来自于动态交联的天然聚合物和一种模拟过氧化氢酶的纳米酶,具有可注射、自愈合和生物相容性的特性。更重要的是,由于催化纳米酶的加入,得到的水凝胶体系可以有效分解内源性的H2O2生成O2。体外实验表明,纳米酶增强水凝胶成功地缓解了RA的缺氧和氧化微环境,从而为BMSC的增殖和成骨提供了合适的三维微环境。为了进一步研究干细胞在体内的治疗效果,我们将3D打印的BMSC包埋的钛合金支架移植到RA动物模型的大范围骨缺损中。纳米酶增强的干细胞水凝胶能有效抑制炎症细胞因子,促进假体界面的骨融合。
论文链接:https://doi.org/10.1038/s41467-022-34481-5
2、二氧化铈纳米酶的小分子自组装协同治疗动脉粥样硬化


动脉粥样硬化(AS)是以血管内活性氧(ROS)生成增加、脂质过氧化和炎症反应为特征的疾病,是世界范围内血管疾病的主要原因。AS微环境中氧化应激和炎性分子表达水平的调节尤为重要,各种抗炎药已被评估用于治疗AS。然而,它们在清除ROS方面的非特异性分布、快速清除和低效限制了其在AS治疗中的疗效,因此,迫切需要开发靶向给药和有效治疗AS的替代策略。
研究者提出了一种新的策略,将特定的小分子配体ZOL与Ce离子组装,以获得具有清除ROS、抗炎和药物转运能力的多功能CZ NCs。基于这一策略,开发了血小板膜修饰纳米颗粒PCZ@PB NCs,作为治疗AS的仿生纳米酶。与传统的治疗动脉粥样硬化的药物传递平台(脂质体、二氧化硅、环糊精等) 相比,首先,CZ NCs与PB的组装简单,不仅解决了PB不溶性导致的利用率低的问题,而且通过自身的酶活性,如空气中的氧气,有效地保持了药物在储存和运输过程中的活性,免受环境氧化因素的影响。其次,与传统的被动给药相比,模拟血小板不仅可以实现对AS微环境的主动和被动靶向,而且可以选择性地向炎性巨噬细胞聚集,有利于AS的精准治疗。最后,与单一给药系统相比,以PCZ@PB为载体的纳米粒对AS也有治疗作用,并能协同药物的抗AS作用。这一纳米酶为扩大氧化铈纳米材料的生物医学应用提供了前景,并拓宽了协同治疗其他炎症性疾病的潜力,无论是单独还是通过进一步的药物输送。
论文链接:https://www.nature.com/articles/s41467-022-34248-y
3、POD纳米酶用于光/pH激活的细菌催化/光动力治疗


细菌感染每年折磨着全世界数百万人,对公共卫生造成严重威胁。抗生素的出现大大减轻了感染者的痛苦。然而,抗生素的滥用加速了耐多药菌株的进化,给抗生素依赖治疗带来了巨大的困境。更糟糕的是,新抗生素的开发落后于多重耐药性的增长。因此,迫切需要发现新的无抗生素抗菌途径来解决这一问题。
研究者制备了在近红外光下催化活性增强的Ag/Bi2MoO6纳米粒子(Ag/BMO NPs),用于协同纳米酶抗菌治疗和NIR-II光动力抗菌治疗(PDAT)。随着银的引入,Ag/BMO NPs表现出较强的近红外吸收。类酶活性分析证实,Ag/BMO纳米酶在近红外光下表现出增强的类过氧化物酶催化性能。此外,在1064 nm激光作用下,NIR-II PDAT产生了大量的单线态氧。抗菌实验结果表明,具有良好生物相容性的Ag/BMO NPs在1064 nm激光作用下能有效杀灭耐甲氧西林金黄色葡萄球菌(MRSA)(~99.9 %)。此外,通过密度泛函理论(DFT)计算,详细地揭示了级联纳米催化反应的自补充、可持续性和耦合的协同作用的工作机制。研究者相信纳米酶具有优异的光增强类酶活性和可持续产生1O2和·OH的能力,可以作为治疗感染性疾病替代抗生素。
论文链接:https://www.nature.com/articles/s41392-022-00900-8
4、再生表面Fe2+实现Fe3O4纳米酶持续的类POD催化反应


Fe3O4是一种开创性的纳米酶,但对其类过氧化物酶(POD)催化机制目前仍然未研究通透彻。到目前为止,提出了多种POD催化机制,普遍认为的是高活性的羟基自由基(·OH)是由类Fenton反应产生的。这些机理都有一个共同的理论前提:由于纳米酶的催化主要发生在颗粒表面或界面上,因此只有表面活性中心对纳米酶的类酶性质起决定性作用。然而在Fe3O4纳米酶引发的类Fenton反应中,作者发现表面的Fe2+在被氧化后很难恢复,这意味着,如果纳米酶只有表面原子在类催化中发生作用,那在长期催化后,酶活性是否会因耗尽而失活?
研究者在此提出了一个被忽视的问题,关于纳米酶的POD机理,通过表征参与环状POD催化的循环Fe3O4纳米粒子的化学组成和催化活性。表面和内部的Fe2+都赋予了Fe3O4纳米酶类似POD的性质。一般情况下,粒子内部的Fe2+可以将其电子转移到表面,再生表面的Fe2+,支持催化反应。这一过程通常伴随着过量氧化的Fe3+向外迁移,这可能是一个限速步骤。随着催化作用的继续,Fe3O4慢慢氧化为γ-Fe2O3,伴随着耗竭的类酶活性,类似于传统的磁铁矿低温氧化,只是电子受体不同。具有参与电子转移和离子迁移的内部原子的纳米酶的这种自耗尽特性被典型的模型材料--磷酸铁锂(LiFePO4)进一步证明,该材料含有氧化还原活性金属中心和包裹在刚性磷酸网络中的可移动的锂离子(Li+)。本文揭示了内部原子也可能有助于纳米酶催化的反应,即使这些反应发生在纳米粒子的表面,这在设计、调节和应用纳米酶时是需要考虑的。
论文链接:https://doi.org/10.1038/s41467-022-33098-y
5、免疫调节型纳米酶

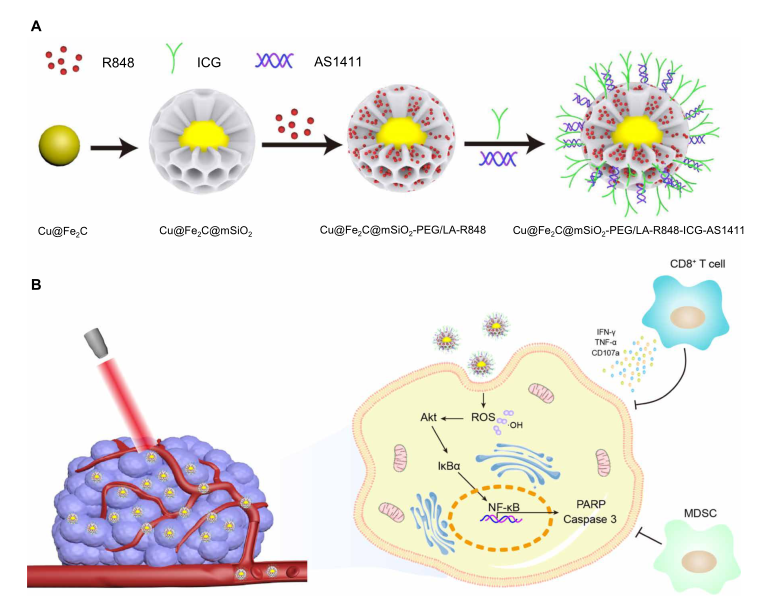
研究者设计了一种基于Cu@Fe2C@mSiO2-R848-ICG-AS1411的免疫调节纳米酶,用于实时可视化和协同癌症治疗。作为多功能候选材料,Fe2C NPs是一种具有优良磁性、光热转换性能和过氧化物酶样活性的生物相容性NP,可作为磁共振成像造影剂、光热治疗(PTT)和CDT剂。铜离子可以进一步增强碳化铁NPs的光热转化性能和过氧化物酶样活性,从而优化治疗效果。同时,协同癌症治疗可以提供大量的癌细胞片段作为抗原,随后通过抗原呈递激活免疫系统进行癌症免疫治疗。为了进一步提高肿瘤免疫治疗的效果,介孔二氧化硅因其良好的体内生物相容性和丰富的介孔结构而被选为智能药物输送系统,最终实现免疫激动剂(R848) 的有效负载和pH/温度控制释放,并与相变材料[聚乙二醇(PEG)/月桂酸(LA)]协同作用。吲哚菁绿(ICG)可以实现对深部肿瘤的近红外区(NIR-II)荧光成像,具有高空间分辨率。此外,核素特异性适配体 AS1411被连接到免疫调节纳米酶的表面,以实现对肿瘤部位的主动靶向。并从机制上阐明了这种免疫调节纳米酶系统所介导的增强抗肿瘤协同作用,包括内源性免疫原性和负载免疫激动剂诱导的免疫反应的协同作用以及过氧化物酶样活性介导的癌细胞分子信号通路的内在调控,这将为临床医学提供重要的治疗策略和理论依据。
论文链接:
https://www.science.org/doi/10.1126/sciadv.abn3883







暂无评论
发表评论