文 章 亮 点
1. 作者团队展示了一种非常规类型的肽硫酯,由氨基乙基硫酯组成并充当硫酯酶的底物,用于立即靶向细胞的高尔基体(GA)。
2. 作者团队研究发现,硫肽在内质网 (ER)和高尔基体(GA)中的积累会破坏蛋白质的运输,导致细胞死亡。肽硫酯靶向多种细胞的高尔基体(GA),包括人类、鼠和果蝇细胞。
3. 作者的这项工作说明了一种非常规类型的自组装肽硫酯作为一种新的、简便的分子平台,用于靶向 GA 并通过细胞中的酶促活化和氧化还原反应控制细胞命运。
研 究 背 景
高尔基体 (GA)是不同信号通路的重要枢纽。作为所有真核细胞用来分布膜和分泌蛋白的分泌途径的重要组成部分,GA正在成为理解和治疗癌症和阿尔茨海默氏病等疾病的重要目标。越来越多地了解与GA相连的蛋白质,例如从内质网 (ER) 向GA的蛋白质的复杂传递,还强调了开发分子靶向GA以调节细胞功能的独特机会。尽管有几种现有的用于对GA进行成像的分子探针,它们仍然需要预处理,需要相对较长的孵育时间或仅对某些细胞做出反应。因此,开发靶向GA的分子的需求仍然没有得到满足。我们最近关于硫磷肽立即靶向GA并选择性杀死癌细胞的工作揭示了两个重要的见解: ( i) 酶促反应可实现即时和有效的靶向GA,以及 (ii) 氧化还原反应可使适当的硫磷肽通过自组装,二聚作用在细胞的GA中积累,以及与半胱氨酸蛋白 (CRPs) 的合理反应。在用其他含硫部分取代硫代磷酸酯基团时,我们意外地发现,荧光肽硫酯立即靶向多种细胞的GA。由氨基乙基硫酯作为自组装 D-二苯丙氨酸 (ff)末端的酶响应盖和硝基苯并恶二唑 (NBD) 作为另一端的载体组成, 肽硫酯(1 和 3,方案 1)由作为自组装 D-二苯丙氨酸 (ff)末端的酶响应和作为另一端的荧光团的硝基苯并恶二唑 (NBD) 组成,肽硫酯(1 和 3,方案 1)用于蛋白质合成的常规肽硫酯发生S到 N 酰基转移。肽硫酯 ( 1或3 ,方案1) 高于或低于其临界胶束浓度 (CMC),主要通过小凹介导的内吞作用或大泡作用进入细胞(方案 1)。在被高尔基体相关的硫酯酶水解后,如 PPT1, LYPLA1, 和 LYPLA2, 生成的硫肽(2或 4)(方案1和方案 S4)形成二聚体并可能与 GA 中的 CRPs 反应,在它们使 GA 饱和后,肽硫醇在ER中富集。在大约 5-10 倍用于 GA 成像的浓度下,肽硫酯在 ER 和 GA 中积聚,导致ER应激,并破坏蛋白质转运(例如,NRAS转运),从而通过多种途径导致细胞死亡。虽然将 D-二苯丙氨酸(ff)更改为 L-二苯丙氨酸 (FF) 保持肽硫酯 (5) 的 GA 靶向能力,但额外的控制 (7-13, 方案 S5),例如用甲基磺酰基或硫醚替换硫酯,将硫酯切换到羧基酯或酰胺,或将 D-苯丙氨酸突变为D-丙氨酸,不能靶向GA。1 立即靶向多种细胞的GA,包括人类、鼠和果蝇细胞。此外,1 重定向NRAS的分布。这项工作说明了一种非常规类型的自组装肽硫酯作为一种新的、简便的分子平台,用于靶向 GA 并通过细胞中的酶促活化和氧化还原反应控制细胞命运。
图 文 速 读

方案1 靶向气体的酶响应肽硫酯力
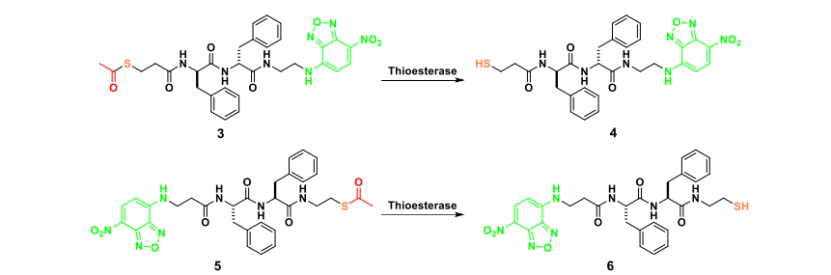
方案 S4. 3、4、5、6的化学结构及相应的酶促反应
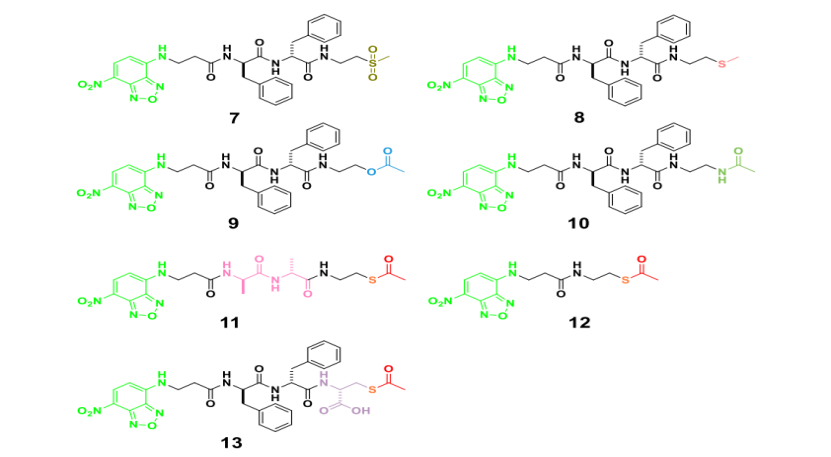
方案 S5. 肽硫酯类似物的化学结构
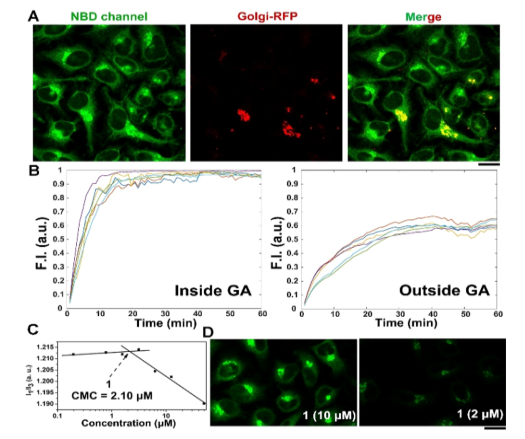
图 1. (A) 用 1 (10 μM, 30分钟) 处理的高尔基体-RFP 转染 HeLa 的CLSM。(B) 用 1 (10 μM, 60 min)处理的 HeLa GA 内外荧光的单细胞分析。(C)1 的CMC。(D)用 1(10μM 或 2 μM)处理30分钟(比例尺 20 μm)的 HeLa 的CLSM。
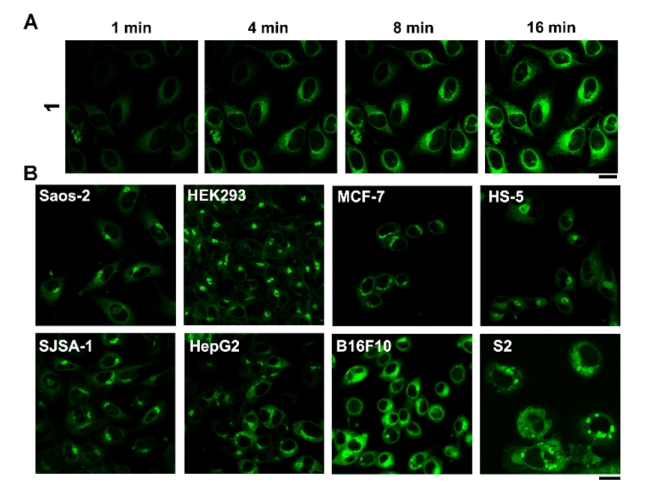
图 2. (A) HeLa 用 1 处理 1、4、8 和 16 分钟和 (B) 不同细胞(Saos-2、HEK293、MCF-7、HS-5、SJSA-1、HepG2、B16F10 和 S2)用 1 处理 8 分钟([1]=10 μM,比例尺 20 μm)。

图 3. (A) 细胞毒性和 (B) 1 对不同细胞系(HeLa、HEK293、Saos-2、MCF-7、HS-5、SJSA-1 和 HepG2)的 IC50 (C) 在有或没有 1 (10 μM, 30 min; 比例尺 20 μm) 预处理后用 NRAS 抗体对 MCF-7 进行 ICC 染色。
总 结 与 展 望
总之,这项工作说明了几种肽硫酯经过酶水解并立即在 GA 处积累。尽管 2 也在 GA 处缓慢积累,硫酯基团在体内充当硫醇的预成型体和一种高能键,是酶促反应的独特且有用的构件。这种即时的 GA 靶向过程不仅可以对 ER 和 GA 跟踪进行成像,而且还为开发超分子组件以破坏蛋白质跟踪和进一步控制细胞命运提供了新的见解。尽管详细机制仍有待进一步阐明,但硫肽的二聚化以及与 GA中CRP 的可能反应有助于GA 积累,为调节 GA 信号级联提供了新途径。








暂无评论
发表评论